前列腺癌是全球男性中发病率第二高的恶性肿瘤,精准诊断和个性化治疗一直是临床和科研的重点。然而,传统的诊疗手段在灵敏度、特异性及靶向治疗效果上仍存在局限性。近年来,“放射诊疗一体化”的核医学概念逐渐成熟,通过靶向肿瘤特异性受体的放射性药物,可以在诊断阶段评估靶点表达水平,并通过特定放射性核素的结合,实现肿瘤的精准治疗。这一新型诊疗模式已被证实可显著提升患者的治疗效果。
本研究聚焦于胃泌素释放肽受体(GRPR),这一受体在前列腺癌尤其是早期阶段的肿瘤细胞中高表达,且在良性前列腺增生中无显著表达差异。研究团队设计并合成了三种新型GRPR拮抗剂放射性药物:AU-RM26-M2、AU-RM26-M3 和 AU-RM26-M4。这些药物基于优化的正电荷连接子结构,提升了受体结合亲和力和代谢稳定性。动物实验和细胞模型均表明,AU-RM26-M4显示出最高的肿瘤摄取能力和较低的背景信号,特别是在前列腺癌PC-3细胞模型中的应用效果尤为显著。
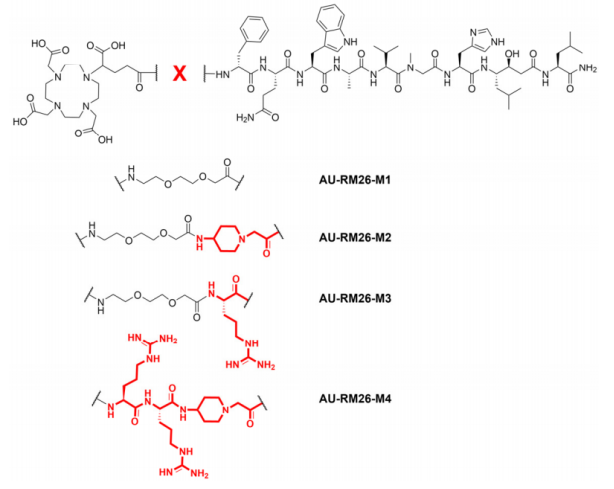
AU-RM26-M1参比物(DOTAGA-PEG2-[Sar11]RM26)、AU-RM26-M2(DOTAGA-PEG2-Pip-[Sar11]RM26),AU-RM25-M3(DOTAGA-PEG2-Arg-[Sar11]RM26)和AU-RM26-M4(DOTAGA Arg-Arg-Pip-[Sar 11]RM26]的化学结构。
1. 受体结合与细胞摄取:优化的正电荷连接子(如Pip和Arg组合)显著提高了药物与GRPR的结合力。在PC-3细胞模型中,AU-RM26-M4的受体结合亲和力(KD值)比其他候选药物高出2个数量级,其细胞摄取量也远高于其他拮抗剂。
2. 代谢稳定性:在小鼠血浆代谢实验中,AU-RM26-M4展现出优异的代谢稳定性,且通过正电荷连接子的设计成功减少了肾脏放射性积累。
3. 体内分布:AU-RM26-M4在小鼠肿瘤组织的摄取量达到15%注射剂量/克,比AU-RM26-M1提升近两倍,同时健康组织中的背景信号较低,为诊疗一体化的成像和治疗提供了更优方案。
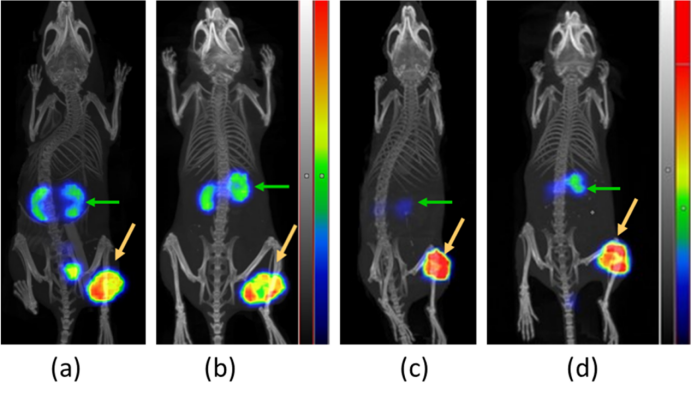
SPECT/CT影像对比,展示了[111In]In-AU-RM26-M2和[111In]In-AU-RM26-M4在4小时和24小时的肿瘤显影效果,特别突出了AU-RM26-M4在肿瘤部位的高信号和肾脏中的低信号。
这些优化后的GRPR靶向放射性药物不仅在前列腺癌的精准诊断中具有广泛应用潜力,还为核医学领域的诊疗一体化探索提供了宝贵的基础数据。未来,该技术有望扩展至其他GRPR高表达肿瘤类型,推动个性化核医学诊疗的全面发展。
该研究由瑞典乌普萨拉大学、希腊国家“德莫克里托斯”核研究中心等多家国际知名机构联合开展,研究团队成员包括Anna Orlova教授等资深学者。多学科、跨国界的合作模式是本研究成功的关键。
以GRPR为靶点的新型放射性药物为前列腺癌诊疗带来了新方向,其在分子设计、代谢稳定性和靶点特异性上的综合优势,标志着核医学领域的重要进步。这项研究不仅提供了更精准、更高效的诊疗手段,也为未来核医学诊疗的发展奠定了坚实基础。