作为α核素Ac-226(t=29.37h)优越的物理化学性质,使得其在重大恶性疾病治疗诊断上具有极大的应用前景,利用其发射的γ射线进行诊断、同时利用其发射的α粒子进展治疗,Ac-226发射能量158和230 keVγ光子,非常适合定量SPECT成像,同时还发射4个高能α粒子用于治疗。
研究团队评估了临床前226Ac靶向α疗法方案,核素Ac-226标记crow-TATE,其靶向神经内分泌肿瘤,通过 SPECT进行示踪成像、生物分布和治疗研究。临床前 SPECT/CT获取了从158和230 keV发射重建的定量图像如下:
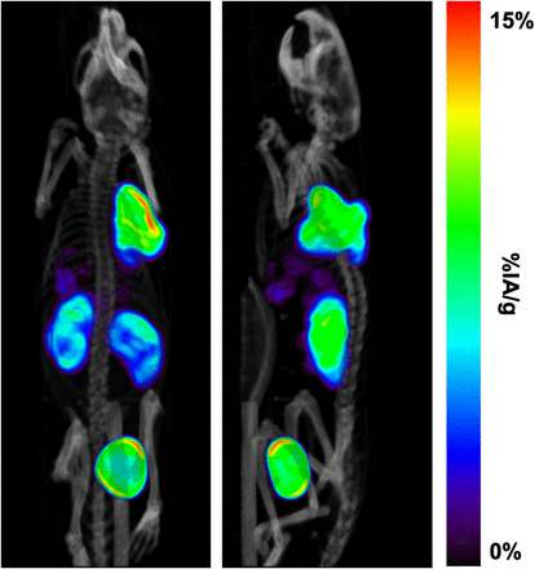
模型小鼠生物分布研究表明,该Ac-226-crow-TATE 在肿瘤中具有高摄取(注射后30小时>5%IAg) 和保留,估计平均吸收剂量系数为222 mGy/kBq,对照组的中位生存期从对照组的7d 延长至16、24和27 kBq处理组的125、250和375 d,通过减缓肿瘤生长延长生存期,未观察到体重减轻或毒性。因此226Ac作为独立的治疗同位素,除了其明确的诊断能力外,还可用于评估匹配的225Ac-放射性药物的治疗评估。对于Ac-226放射性药物将在最大剂量和毒性研究上进行深入探索。
发射α粒子的放射性药物治疗对转移性癌症患者具有广阔前景,α粒子直接向癌细胞提供细胞毒性辐射剂量,同时保留健康的正常组织。225Ac(t=9.92 d) 放射性药物已显示出极高的临床前和临床价值,主要原因是其整个衰变链中发射了4个α粒子。然而,225Ac缺乏直接成像的y发射,只能通过其子代放射性核素释放的y发射进行检测和成像221Fr (t=4.80 min;218 keV;11.4%) 和,,213Bi(t=45.6 min;440 keV;25.9%)。而这种通过间接衰变子体进行示踪成像会引入很多不确定性,比如放射性衰变子代由于化学性质的改变而游离,从而失去靶向性。因此,体内锕的直接和定量检测可能对患者的临床前放射性药物开发和临床治疗计划的优化具有显着益处。而226Ac(t=29.37 h) 非常适在治疗的同时进行诊断,且与225Ac放射性药物在体内具有相同的放射化学和药代动力学优势。

在评估可行性并展示226Ac作为具有临床前放射性药物的独立治疗诊断同位素。生物偶联物冠状TATE 可作为2型生长抑素受体 (SSTR) 的激动剂,后者在晚期进行性神经内分泌肿瘤的细胞表面过表达。以前,crow- TATE 已使用其他放射性金属标记,包括155,161Tb和225Ac, 并已证明肿瘤高摄取和出色的体内稳定性。SSTR 也在许多正常组织和器官中表达,包括胃肠道、胰腺、肺和肾脏。由于这种正常的组织表达,使 用 SSTR 靶向放射性核素治疗量化对正常健康组织的积累和辐射剂量非常重要。该团队在荷瘤小鼠中使用【c-226】Ac-crown-TATE进行定量SPECT成像、生物分布概况、药代动力学、针对靶向肿瘤和健康器官的内部放射剂量测定均显示出优异临床前和临床研究价值,以及在肿瘤控制上的研究前景,同Ac-225相比在示踪成像方面更具优势,可直接利用其发射158和230keV的γ光子进行成像,治疗方面也有4个高能A粒子发射,因此,Ac-226将会是下一代示踪诊断双功能α核素。
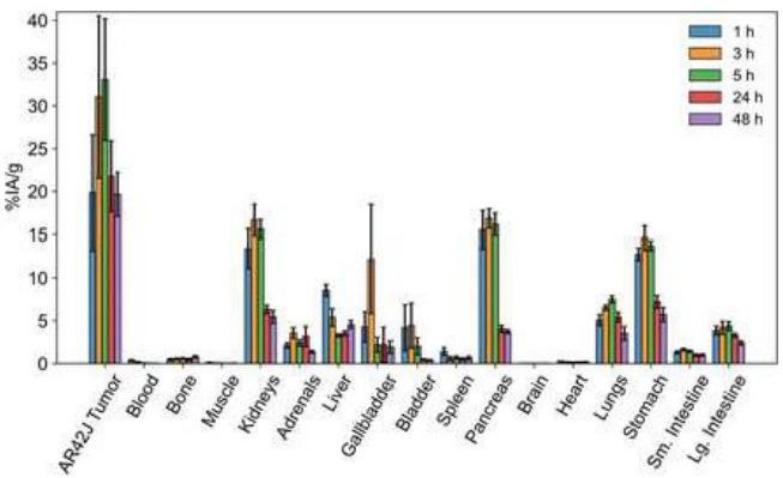
生物分布研究中显示,[226Ac]Ac-crow-TATE 在肿瘤中表现出高摄取,在注射后5小时达到峰值(33.1±7.1%IA/g), 注射后48小时具有适当的保留(19.7±2.6%IA/g) 。 肾脏、胰腺、胃和肺在注射后的前5小时内出现摄取;注射后24-48小时放射性药物被清除。
[226注射后42、1、3、5和24小时在AR48J 肿瘤的 NRG 小鼠中AcJAc-crown-TATE。
本研究证实了226Ac 作为独立的治疗诊断放射性同位素与临床前放射性药物[226Ac]Ac-crown- TATE 在神经内分泌肿瘤模型小鼠模型中的诊断和治疗价值,且定量SPECT成像获得的生物分布,与离体活性测量具有很强的正相关性。治疗研究表明226与对照组相比,[226Ac]Ac-crown- TATE 通过减缓肿瘤生长延长了中位生存期,而不会引起可观察到的副作用或毒性。需要进一步的研究来确定这种放射性药物的最大耐受剂量和潜在毒性。总体而言,已经证明226Ac 可以作为诊断和治疗放射性同位素发挥双重作用。这项工作提出226Ac 可以有利于临 床前放射性药物的开发,并可能在未来促进个性化的患者治疗。