Monopar Therapeutics Inc. (Nasdaq: MNPR) ,一家专注于为癌症患者开发创新疗法的临床阶段生物制药公司,近日宣布其正在进行的开放标签 MNPR-101-Zr 的I期成像和剂量学临床试验的积极早期数据,证实了 MNPR-101-Zr 在人类中的肿瘤靶向能力。
MNPR-101 是 Monopar 专有的同类首创人源化单克隆抗体,靶向表达尿激酶纤溶酶原激活剂受体(uPAR)的癌症。这些包括大多数三阴性乳腺癌、结直肠癌、膀胱癌、卵巢癌、胃癌和胰腺癌。
研究人员在使用MNPR-101-Zr(一种与MNPR-101结合的Zr-89成像放射性同位素)后168小时(7天)拍摄了已知高uPAR表达癌症类型之一的癌症患者的全身正电子发射断层扫描(PET)图像。结果如下图所示,显示了MNPR-101-Zr在转移性肿瘤中相对于正常组织的特异性、持久性和摄取。高摄取区域也与之前在常规FDG PET成像中观察到的转移性肿瘤的位置一致。
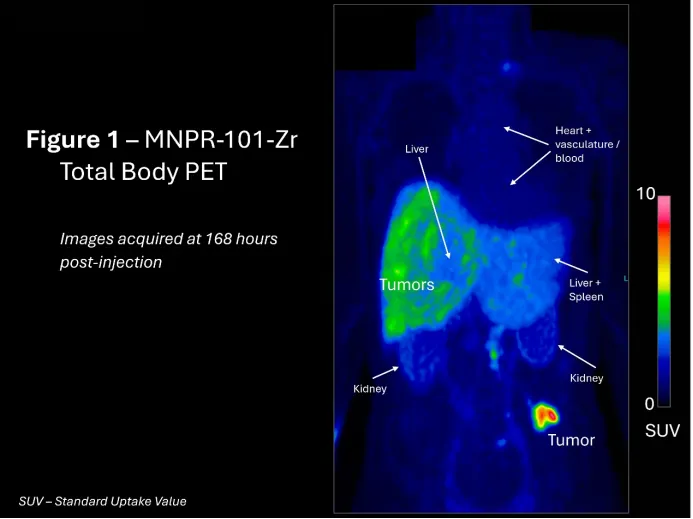
图示为注射MNPR-101-Zr后168小时获得的全血PET图像
Monopar 首席运营官 Andrew Cittadine 表示:“这正是我们希望看到的——肿瘤中高度优先的摄取。”
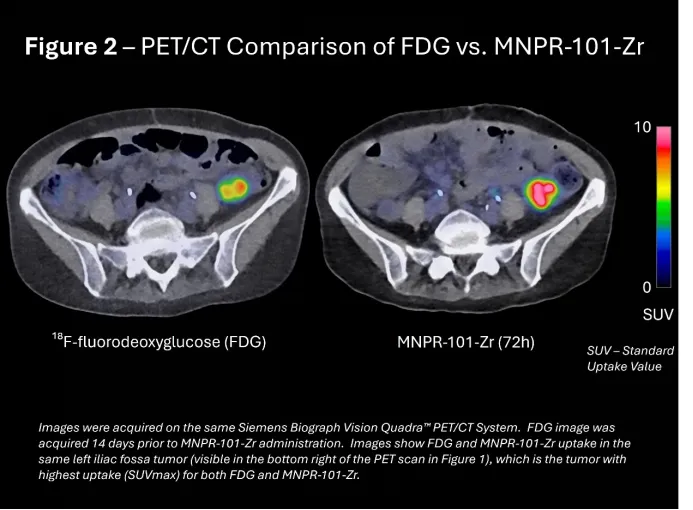
图示将MNPR-101-Zr 与 FDG(检测转移性肿瘤的金标准)进行了评估,显示在同一台PET/CT 扫描仪上成像的相同肿瘤中 FDG 摄取与相同肿瘤中 MNPR-101-Zr 摄取的比较。
MNPR-101-Zr 的I期成像和剂量测定临床试验首席研究员 Rodney Hicks 教授表示:“在墨尔本治疗诊断创新中心,我们使用了世界上最灵敏的 PET/CT 扫描仪之一分别进行 FDG 和 MNPR-101-Zr成像,结果显示 MNPR-101-Zr 在已知疾病部位实现了摄取,并保留到晚期,这为未来的治疗转化带来了希望。“
Monopar 最近在澳大利亚获得批准,可以启动 MNPR-101-Lu的I期治疗临床试验,该试验目前计划于今年第四季度启动。
Monopar 首席执行官 Chandler Robinson 医学博士说:“我们期待在即将于 2024 年 10 月 19 日至 23 日在德国汉堡举行的欧洲核医学协会 2024 年年会上分享更多数据。我们的摘要已被科学项目接受为‘顶级口头报告’。”
关于Monopar Therapeutics Inc.
Monopar Therapeutics是一家临床阶段的放射性药物公司,专注于为癌症患者开发创新疗法,包括用于晚期癌症成像的I期MNPR-101-Zr和用于治疗晚期癌症的晚期临床前期产品-MNPR-101放射免疫治疗(RIT),以及针对实体癌的早期开发项目。