在德克萨斯州圣安东尼奥举行的2024年美国泌尿学会(AUA)年会举办的一场晚期前列腺癌海报审评会议上,Ahmed Mahmoud博士介绍了一项研究的结果,该研究评估了转移性去势耐受性前列腺癌症患者的部位特异性疾病对177Lu-PSMA-617的反应。
2022年,美国食品药品监督管理局(FDA)批准177Lu-PSMA用于治疗既往已接受雄激素受体通路抑制剂和紫杉烷类化疗的PSMA阳性mCRPC患者。自那时起,多项研究评估了177Lu-PSMA的反应;然而,很少有研究描述基于疾病进展部位的反应。在这项研究中,研究人员试图通过转移扩散的部位来评估对177Lu-PSMA的反应。
他们对2022年4月至2023年9月期间在梅奥诊所接受177Lu-PSMA治疗的273名患者进行了回顾性分析。在这273名患者中,他们确定了76名(28%)仅患有骨骼或淋巴结疾病的患者。提取所有患者的患者水平临床病理变量、随访影像学和临床结果数据。分别使用Chi-square和Kruskal-Wallis检验对分类变量和连续变量进行单变量比较。
这76例患者根据转移性疾病的部位分为两组:纯骨病(n=52; 68%)和纯淋巴结疾病(n=24; 32%)。骨病组患者在开始177Lu-PSMA治疗前具有较高的Gleason评分(p = 0.019)和PSA水平(p = 0.16)。
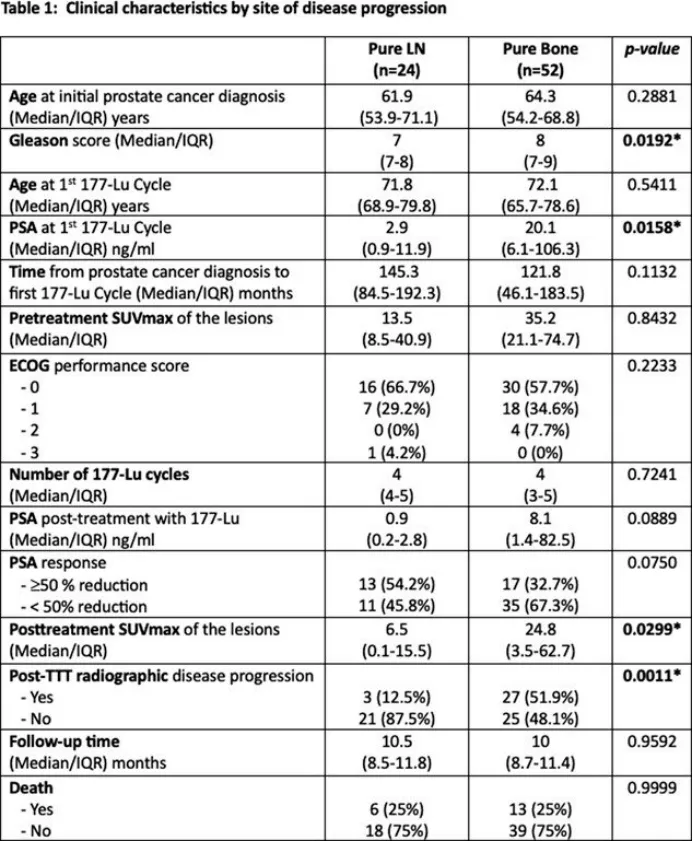
在第一个177Lu-PSMA周期的中位随访10.2个月(IQR:8.6-11.5)时,两组治疗后PSA动力学无显著差异。然而,与骨病组相比,淋巴结疾病组患者在治疗后转移病灶的SUVmax降低(p=0.0299)和影像学疾病进展率降低(p=0.0011)方面表现出持久的反应。
Mahmoud博士得出结论,与仅患有骨骼疾病的患者相比,接受177Lu-PSMA治疗的仅患有淋巴结疾病的患者具有持久的反应。需要进一步的前瞻性研究来验证这项研究的结果。
作者: Ahmed Mahmoud医学、博士,明尼苏达州罗切斯特市梅奥诊所泌尿科研究员
撰文:Rashid Sayyid,医学博士,理学硕士-多伦多大学泌尿肿瘤学会(SUO)临床研究员,在2024年5月3日星期五至5月6日星期一于德克萨斯州圣安东尼奥举行的2024年美国泌尿学会(AUA)年会期间在推特上@rksayyid。
参考:
1、FDA D.I.S.C.O.: Burst Edition: FDA approval of Pluvicto (lutetium Lu 177 vipivotide tetraxetan) for the treatment of adult patients with prostate-specific membrane antigen-positive metastatic castration-resistant prostate cancer who have been treated with androgen receptor pathway inhibition and taxane-based chemotherapy. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-disco-burst-edition-fda-approval-pluvicto-lutetium-lu-177-vipivotide-tetraxetan-treatment-adult. Accessed on May 6, 2024.