小胶质细胞是髓系细胞,在介导中枢神经系统 (CNS) 中的炎性反应方面起重要作用。在其他任务中,小胶质细胞负责识别和消除外来入侵者,并修复由损伤引起的局部 CNS 组织损害。此外,小胶质细胞还在神经回路调节和一般平衡中起重要作用。近年来,慢性神经炎症或神经胶质增生已成为神经退化研究的前沿,作为神经炎症的主要细胞介导物,小胶质细胞已成为这项工作的主要重点。尤其是,主要研究工作方向是阐明小胶质细胞在阿尔茨海默病 (AD) 的发病机理中的确切作用。
小胶质细胞受体-接头蛋白复合体 [称为骨髓细胞 2 表达的触发受体 (TREM2) 和 12 kDa DNAX 激活蛋白 (DAP12)] 的功能经证实在 AD 和帕金森病等多种神经退行性疾病中非常重要。TREM2 和 DAP12 之间的相互作用很可能介导与吞噬和碎片清除、促炎性细胞因子产生和释放的调节,以及促进小胶质细胞增殖和存活的转录变化有关的多种神经炎性反应。因此,TREM2/DAP12 功能变化直接影响小胶质细胞激活的时间和程度,从而影响神经元功能和存活。
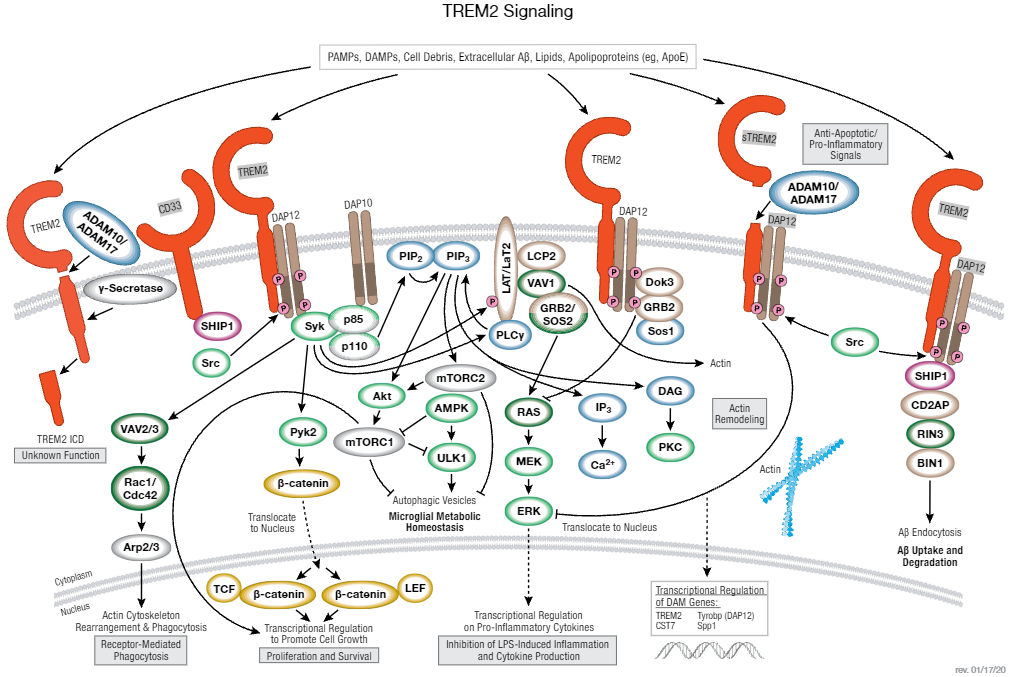
TREM2 由三个不同的结构域组成。第一个是含有一个免疫球蛋白结构域的胞外感应蛋白,该免疫球蛋白结构域结合病原相关分子模式 (PAMP) 分子、损伤相关分子模式 (DAMP) 分子、细胞碎片、脂质和载脂蛋白。此外,TREM2 胞外结构域会对 AD 中累积的 Aβ 产生反应。ADAM 家族酶 ADAM10 和 ADAM17 引起的裂解活化可释放 TREM2 胞外结构域 (sTREM2) 的分泌型变体,该变体可能在小胶质细胞存活和促炎性信号传播中起保护作用。第二个 TREM2 结构域是其与 DAP12 结合的跨膜结构域。第三个 TREM2 结构域是其通过 γ 分泌酶裂解 TREM2 而释放的短细胞浆尾区 (TREM2 ICD)。TREM2 ICD 的功能尚不清楚。
胞外配体结合会激活 TREM2,这反过来会激活 DAP12,从而导致胞内信号转导事件发生级联反应。具体而言,DAP12 包含一个基于免疫受体酪氨酸的激活基序 (ITAM),其中酪氨酸残基在 TREM2 结合配体时会被磷酸化。然后这会募集 Syk 激酶来激活下游信号转导分子,例如数种 Vav 鸟嘌呤核苷酸交换因子、非受体酪氨酸激酶 Pyk2、磷脂酰肌醇 3-激酶(PI3K;在 DAP10 的协助下被募集到膜上)、磷脂酶 Cγ (PLCγ) 和 T 细胞激活 1 和 2 (LAT1/2) 的膜结合连接物。根据具体环境,这些信号转导级联可差异性和协同性参与,从而影响各种小胶质细胞功能,包括受体介导的吞噬、β-catenin 和 mTOR 复合体 1 介导的转录调控、通过 PIP 2/3 介导的 AKT 和 mTOR 复合体 2 激活实现的代谢平衡、导致促炎性分子转录调控的 RAS/MEK/ERK 激活,以及导致肌动蛋白重构的钙调节。
DAP12 被蛋白酪氨酸激酶 Src 磷酸化可进一步调节下游信号转导级联。尤其是,以不依赖于 Syk 而依赖于 Src 的方式激活 DAP12 会通过依赖于 Src 的磷酸化和接头蛋白 Dok3 及其相关蛋白 Grb2 和 Sos1 的募集抑制 RAS/MEK/ERK 通路。这会阻止 RAS-ERK 通路的激活,从而减少促炎性细胞因子的分泌。ERK 信号转导的这种双模调控说明一个高度调控的 TREM2/DAP12 复合体的重要性,该复合体微调后可调节相应促炎性反应。最后,DAP12 被 Src 磷酸化会介导与脂质磷酸酶 SHIP1 的相互作用。SHIP1 与接头蛋白 CD2AP 相互作用,CD2AP 结合 RAB5 激活的鸟嘌呤核苷酸交换因子 RIN3。反过来,RIN3 结合 BIN1,BIN1 是一种参与内吞和受体运输的蛋白,也是一个众所周知的迟发性 AD 的风险位点。在 AD 疾病状态下,SHIP1/CD2A/RIN3/BIN1 复合体可能会增加小胶质细胞对 Aβ 的吸收和降解。除此功能外,新的证据表明膜蛋白 CD33 与 TREM2 之间存在复杂的交互作用,结合 CD33 的 SHIP1 借此可抑制 Syk 激活,从而抑制 PI3K 激活、自噬和小胶质细胞代谢平衡。
AD 患者全基因组关联研究在小胶质细胞的 TREM2/DAP12 信号转导轴内发现了许多疾病风险位点。了解该复合体及其下游效应子的功能变化可阐明小胶质细胞在 AD 和其他神经退行性疾病的发病机理中的作用。