概述:
帕金森病(PD)是一种导致神经退行性疾病的异常情况。它具有黑质神经元丧失、纹状体多巴胺功能减少和α-突触核蛋白形成的特征。其中,当SNCA基因中的G51D突变出现时,会导致该疾病的特别侵袭性形式。最近,科学家利用CRISPR/Cas9技术成功将G51D突变导入了内源性大鼠SNCA基因中。通过对这一基因突变的大鼠进行观察,他们发现这一模型呈现出与PD高度相关的早期疾病表型。在研究中,科学家对野生型(WT)、SNCAG51D/+和SNCAG51D/G51D大鼠进行了衰老过程(5、11和16个月)的观察,并使用一种称为18F-DOPA PET的技术来进行动态成像和建模。通过18F-DOPA PET数据的分析,他们成功确定了与PD早期症状高度相关的特征。
这一突破性的遗传模型为帕金森病的早期检测提供了新的途径,也为我们更好地了解这种疾病的起源和发展提供了有力证据。
nanoScan® PET/CT实验结果:
Fischer 344大鼠18F-DOPA PET成像优化
为了获得更清晰的大鼠纹状体图像,研究人员改进了体内PET成像实验的方法。通过使用最新的nanscan PET/CT扫描仪(medio Medical Imaging Systems)和Nucline™v2.01软件,他们成功地获取了高质量的图像。为了测试图像的质量,研究人员使用了18F-FDG均质溶液和美国电气制造商协会(NEMA) NU-4小鼠图像质量(IQ)模型。通过对多个参数进行调整,并进行重构处理(图1),最终得到了令人满意的成像效果。当涉及到改进体内成像和动力学建模的方法时,采用迭代方法是最有希望的重构场景。同时,使用两只大鼠的初步实验数据,优化了体内成像和动力学建模方法(图2),通过注射放射性示踪剂前的侦察视图CT图像的获取,进一步提升了实验效果。数据表明,在最近的PD模型PET成像研究中,动力学建模方法是最佳的。
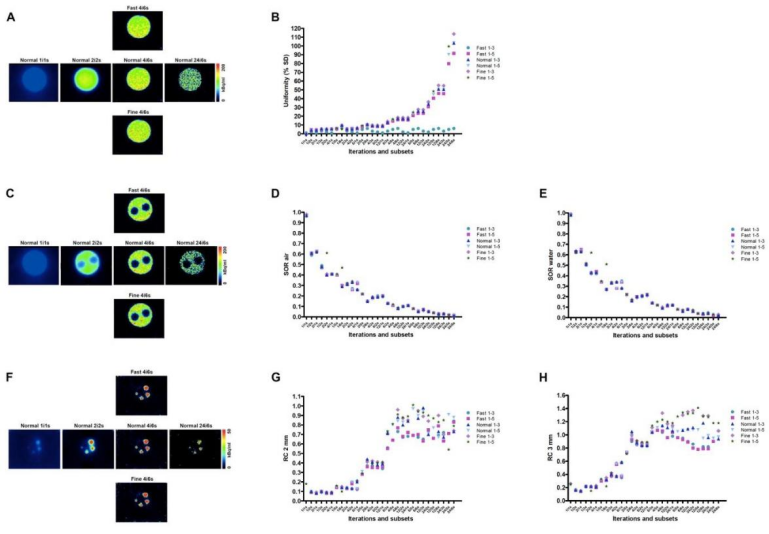
图1所示。PET IQ影像数据。使用了3.8 MBq的18F-FDG造影剂。
(A)使用不同分辨率(快速/正常/精细)、迭代次数和用于重建的子集的不同方法重建PET数据后的中央腔室图像。
(B)重建方法对图像均匀性%标准差(% SD)的影响。
(D,E)活性溢出比(SOR)对空气(D)和水(E)的影响。
(F) 不同直径(1mm - 5mm)的杆状体图像。
(G) (G,H) 2mm棒(G)和3mm棒(H)的回复系数(RC)。
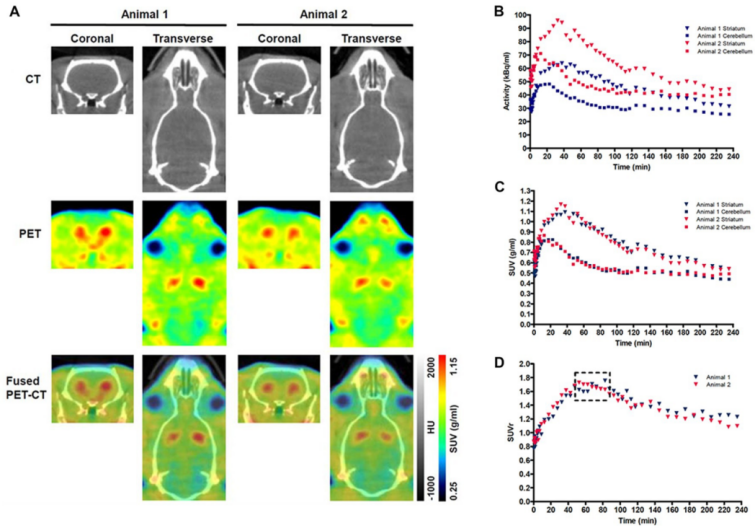
图2。野生型(WT)大鼠的代表性PET-CT图像和标准化摄取值(SUV)时间活动曲线(tac)。
(A) 2只WT大鼠的冠状面和横切面PET-CT图像。HU-Hounsfield单位。图中显示了两只WT大鼠纹状体相对于小脑对18F-DOPA的特定摄取的比活性(B)、SUV TAC数据(C)和SUV比率(SUVr)数据(D)。虚线框表示伪平衡阶段(50-85 min)。
18F-DOPA PET成像显示多巴胺转换缺陷
为了研究大脑在不同年龄和基因型下的变化,研究人员使用了18F DOPA PET技术,分别对对不同年龄(5、11、16月龄)的WT大鼠、SNCAG51D/+大鼠和SNCAG51D/G51D大鼠进行了扫描。共扫描36只大鼠,每个年龄组每个基因型4只大鼠,大鼠进行纵向研究且不会被重新扫描。结果表明16个月SNCAG51D/G51D大鼠的平均多巴胺转换与年龄匹配的WT大鼠相比有所增加。通过对大鼠模型进行研究发现,早期帕金森氏症患者的大脑中多巴胺能缺陷存在不对称性。这意味着在帕金森氏症的早期阶段,大脑某些区域的多巴胺水平会下降,而另一些区域则相对健康。
结论:
据体内PET/CT成像结果显示,SNCAG51D/G51D大鼠在16月龄时,其纹状体多巴胺周转明显增加,但Ki-多巴胺合成和储存并未明显减少。这一发现模拟了帕金森病早期阶段的一部分,并可能反映了人类中观察到的多巴胺系统的代偿性变化。SNCAG51D大鼠作为早期帕金森病病理生理模型,对于研究帕金森病中其他遗传或环境触发因素提供了一个方便的平台。这项研究揭示了帕金森病早期的神经变化,同时也为帕金森病研究带来了新的应用前景。
研究团队:
英国爱丁堡大学生物科学学院
爱丁堡大学生物科学非常出色,爱丁堡大学生物科学学院在教学、研究和创新方面处于领先地位。《泰晤士报》一直将该学院列为全球生物科学领域排名前25位的大学之一。生物科学学院致力于为爱丁堡大学的社会责任和可持续发展作出贡献,学院支持多个团队参与大学可持续发展奖。爱丁堡大学生物科学学院是英国质量最高、影响力最大的生物系之一。在2014年英国国家研究评估中,超过一半的研究活动在质量和范围上被评为“世界领先”,在英国大学教学领域排名第三和第二。