概述:
俄歇电子疗法利用放射性衰变过程中传播极短距离(通常<1μm)的低能电子的细胞毒性。201Tl的半衰期为73小时,每次衰变发射约37俄歇和其他二次电子,可以在体内追踪,因为它的伽马辐射可以进行SPECT成像。尽管201Tl具有有用的核性质,但目前还没有令人满意的双功能螯合剂将其纳入生物偶联物中用于分子靶向。H4pypa, H5decapa, H4neunpa-NH2和H4noneunpa是多齿N和O供体螯合剂,先前已显示对111In, 177Lu和89Zr具有高亲和力。本文报道了[nat/201Tl]Tl3+与H4pypa、H5decapa、H4neunpa-NH2和H4noneunpa配合物的合成以及血清稳定性。所有配体都能快速有效地与[201Tl]Tl3+形成配合物,获得简单的单峰放射色谱图,与DOTA和DTPA相比,血清稳定性大大提高。[natTl]Tl-pypa通过磁共振氢频谱(NMR)、质谱(MS)和X射线晶体学进一步表征,显示出质子依赖的九坐标配合物和带有悬垂羧酸基团的八坐标配合物的存在。合成了一种靶向H4pypa的前列腺特异性膜抗原(PSMA)生物偶联物,并进行了放射性标记。体外评估了[201Tl]Tl-pypa-PSMA在DU145 psma阳性和psma阴性前列腺癌细胞中的摄取情况,发现201Tl的生物还原释放和未螯合的[201Tl]TlCl的细胞摄取特征。采用SPECT/CT成像技术探讨[201Tl]Tl-pypa-PSMA在体内的生物分布及稳定性。在健康动物中,[201Tl]Tl-pypa-PSMA未显示未螯合201Tl所特有的心肌摄取。在携带DU145 psma阳性和psma阴性前列腺癌异种移植物的小鼠中,DU145 psma阳性肿瘤中[201Tl]Tl-pypa-PSMA的摄取高于DU145 psma阴性肿瘤,但不足以用于有用的肿瘤靶向。我们得出结论,与传统的放射性金属螯合剂(如DOTA和DTPA)相比,H4pypa和相关配体在Tl3+螯合方面取得了进步,但由于Tl3+的还原和随后的Tl+释放的脆弱性,H4pypa和相关配体在生物环境中不能长时间抵抗解离。然而,这是首次报道将[201Tl]Tl3+掺入螯合剂-肽生物偶联物中,代表了基于201Tl的放射性药物领域的重大进展。下一代螯合剂的设计必须包括减轻这种生物还原敏感性的特征,这对其他三价重放射性金属来说是不存在的。
健康动物体内生物分布
为了比较[201Tl]Tl-pypa-PSMA、[201Tl]TlCl和[201Tl]TlCl3的生物分布,我们通过尾静脉给药于健康雄性SCID/beige小鼠。注射后每隔15分钟至1小时获取SPECT/CT图像(图1A)。然后移除小鼠,收集器官进行体外生物分布(图1C)。
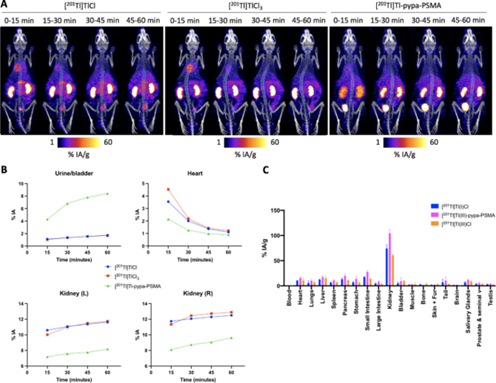
图1。(A)健康动物[201Tl]TlCl、[201Tl]TlCl3和[201Tl]Tl-pypa-PSMA在15、30、45和60 min的体内图像(每组n = 3)。
SPECT/CT图像显示,与[201Tl]Tl-pypa- psma相比,以Tl+或Tl3+方式给药的201Tl在15分钟时具有最初的高心脏摄取(分别为4.5%和3.6% IA(注射活性百分比))。各组小鼠在SPECT/CT扫描前给予[201Tl]Tl-pypa-PSMA (10.7-24.5 MBq, 20 nmol) 2h。SPECT/CT扫描结束后,剔除每只小鼠,解剖脏器,称重,计算放射性,获得放射性示踪剂生物分布的定量数据。
前列腺癌动物模型中的[201Tl]Tl-pypa-PSMA
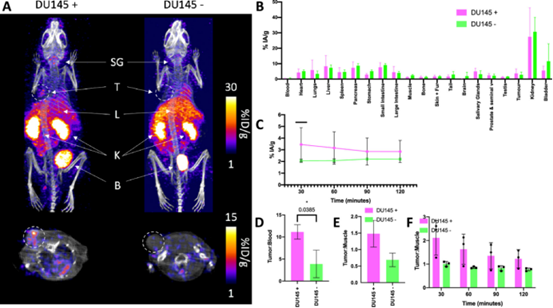
图2。(A) DU145阳性和阴性肿瘤小鼠体内[201Tl]Tl-pypa-PSMA的SPECT图像(0 - 30min)。SG =唾液腺,T =肿瘤,L =肝脏,K =肾脏,B =膀胱。
SPECT图像分析也用于确定[201Tl]Tl-pypa-PSMA的肿瘤/肌肉比率。
研究团队:
伦敦国王学院生物医学工程与成像科学学院。
伦敦国王学院(King‘s College London),是伦敦大学的创校学院之一,全球20强顶尖名校,英国金三角名校和罗素大学集团的知名大学,简称KCL或King’s。2005年《卫报》曾盛赞当时伦敦大学四大学院(伦敦国王学院、伦敦政治经济学院、伦敦帝国理工学院和伦敦大学学院),誉其在英国学术声望可与牛津、剑桥相比拟。国王学院也是英国第四古老的学校,享有世界性的学术声誉,其中伦敦国王学院的成像科学与生物医学工程(研究部)是该校优秀专业之一,于附属医院结合,在临床转化和临床研究中都有巨大贡献。