约2/3的乳腺癌患者病灶为雌激素受体(estrogen receptor,ER)阳性。在活体内无创检测ER,并对其生物活性进行动态监测对作出个体化治疗决策至关重要。国内已有系列临床前和临床研究提示16α-18F-17β-氟雌二醇(16α-18F-17β-fluoroestradiol,18F-FES)正电子发射体层成像(positron emission tomography,PET)可用于ER表达分析,但尚缺乏相应技术规范。本技术标准由国内开展18F-FES PET研究与应用的专家共同执笔,参考自身经验及国内外该领域研究进展后共同商议制定。本技术标准介绍了18F-FES的合成方法和质量控制要求,给出其临床应用场景的推荐,并进行分级。此外,从显像前准备、显像流程、图像分析(正常生物分布、ER阳性和阴性的判定、病灶部位、影响因素、假阴性和假阳性、报告书写)等全流程系统、详尽给出了专家建议,指出了该显像技术的局限性,并对未来应用前景予以展望。该技术标准的制定旨在推动18F-FES PET技术在国内的规范化应用,实现报告解读一致、结果互认、指标可比,为乳腺癌精准诊疗提供重要的分子影像技术支撑。

杨忠毅,许晓平,王明伟等.乳腺癌~(18)F-FES雌激素受体PET技术和应用标准[J].中国癌症杂志,2023,33(08):801-808.DOI:10.19401/j.cnki.1007-3639.2023.08.009.
乳腺癌位居中国女性恶性肿瘤发病率首位,年新发病例数超30万,且近年来仍呈较快增长趋势[1]。雌激素在人体内几乎所有组织中均发挥着重要的生理作用,与雌激素受体(estrogen receptor,ER)特异性结合后,通过形成激素-受体复合物而发挥生物学效应,对细胞、组织的生长、复制等重要环节起调节作用。约2/3的乳腺癌患者病灶为ER阳性,因此在活体内无创检测ER,并对其生物活性进行动态监测对于临床上作出体化治疗决策至关重要。
目前,对标本进行免疫组织化学分析仍是临床上ER检测最为常用的方法,但其存在一定局限性,主要体现在以下几个方面:
① 有创操作;有增加肿瘤种植、转移的风险,且可重复性较差;某些部位的转移灶如骨转移等,存在取材困难而无法确定ER状态的情形。② 半定量技术,由于操作(如受所使用的抗体、固定时间等影响)或读片认知的不同,在不同实验室间、甚至同一实验室内,其结果存在一定程度的差异,据美国临床肿瘤和病理协会的报道,全球范围内有高达20%的ER免疫组织化学检查结果存在错误[2]。③ 由于为离体检测,且受到肿瘤内部异质性的影响,局部取材可能无法真实、全面地反映全部生物学信息;其次,临床由于取材限制,一般仅根据原发病灶来判断整体的ER表达,而原发灶和转移灶ER表达有时可不一致,也使临床治疗决策面临困难[3]。
随着分子影像技术的发展,每年有多种新型的正电子药物被研制和开发出来,并用于临床。通过标记不同的化合物所形成的分子显像剂,可在活体内反映包括ER等多种信息在内的肿瘤生物学特性。雌激素衍生物早在1984年就由Kiesewetter等[4]用18F标记成功,以后16α-18F-17β-氟雌二醇(16α-18F-17β-fluoroestradiol,18F-FES)作为最佳的ER检测的正电子药物已被广泛认可。目前,美国和欧洲食品药品监督管理局已批准18F-FES用于乳腺癌临床正电子发射体层成像(positron emission tomography,PET)(商品名CERIANNA),通过无创、动态地观察ER表达,可协助临床医师作出治疗决策[5]。
本技术标准和指南旨在推动18F-FES PET在国内的规范化应用,实现报告解读一致、结果互认、指标可比,为乳腺癌精准诊疗提供重要的分子影像技术支撑。
技术标准的制定方法
专家构成和撰写
本技术标准由国内最早和迄今开展18F-FES PET检查例数最多的复旦大学附属肿瘤医院核医学科同仁执笔,经由国内开展该显像技术所在单位的专家共同审核,达成一致意见后发布。
文献检索方法
检索的英文数据库为PubMed,中文数据库包括中国知网(CNKI)和万方数据库,检索时限均为建库至2023年3月31日。英文文献检索词主要包括breast cancer、18F-FES及PET;中文文献检索词主要包括乳腺癌、ER显像。文献纳入标准为:报道18F-FES在乳腺癌中临床应用的系统性评价、meta分析、病例报告、前瞻性或回顾性临床研究等。在搜索上述文献的基础上,根据所列的参考文献进行手工扩大搜索。
技术标准的目标人群
与使用人群本技术标准目标人群为拟了解病灶ER表达状态的乳腺癌患者,使用人群为从事乳腺癌18F-FES PET诊断的基础和临床研究的医务工作者。
技术标准的传播、实施及更新
本技术标准发布后,将主要通过以下方式进行传播和推广:① 在学术期刊上公开发表;② 在相关学术会议中进行解读、宣传;③ 通过媒体、公众号(如肿瘤核医学)等进行推广。参与撰写本技术标准的专家组将综合国内外最新研究进展并根据临床实际需求的变化,对本技术标准进行修订。
显像剂的合成和质控
合成
以3-O-(甲氧甲基)-16,17-O-磺酰基-l6-表雌二醇(MMSE)为前体,采取“一锅-两步”法的放射化学合成路线。首先,干燥活化的18F离子与前体MMSE在无水乙腈中100 ℃加热氟化反应10 min;然后再加入盐酸溶液,90℃加热水解反应10 min;最后加入0.2 mol/L NaHCO3溶液调节pH值,经过HPLC分离纯化及固相萃取即获得18F-FES乙醇溶液。经稀释和等渗配制过滤除菌后 进入产品收集瓶[6-7]。
质控
18F-FES的质量分析除药典规定内容外还需有以下内容,具体包括[8]: ① 性状:为无色澄清溶液,pH值范围为 6.0~8.0;② 放射性核纯度:γ能谱仪测定时,能量谱图上除511 keV外,无其他峰;③ 化学杂质:氨基聚醚(K222)低于50 μg/mL,乙腈不得检出;④ 放射化学纯度:达98%以上;⑤ 异常毒性试验:阴性;⑥ 无菌检查和细菌内毒素检测:阴性;⑦ 无菌过滤器完整性检查:完整且不漏气;⑧ 放射性浓度:>10 mCi/mL;⑨比活度:建议为1~3 Ci/μmol。可保证注射量为6 mCi的18F-FES中,其FES的含量仍低于5 μg,从而实现一次生产供多人使用的目的;此外,也不会因过高比活度产生假阴性[9]。
临床应用推荐
18F-FES PET临床应用推荐见表1。
表1 临床应用推荐

注:I类为已证实和(或)一致公认某诊疗措施有益、有用和有效;Ⅱa类为有关证据和(或)观点倾向于有用和有效,推荐采用;Ⅱb类为有关证据和(或)观点尚不能充分说明有用和有效,可以采用;Ⅲ类为已证实和(或)一致公认某诊疗措施无用和无效,并对有些病例可能有害。证据水平A为资料来源于多项随机临床试验或meta分析;B为资料来源于单项随机临床试验或大型非随机试验;C为资料来源于专家共识和(或)小型研究,回顾性研究、注册研究。
显像前准备
详细询问病史
包括既往/目前治疗情况、原发/复发/转移灶ER表达(若有)、其他检查结果和显像目的等。
妊娠和哺乳期妇女慎用该检查
哺乳期妇女行18F-FES显像后需停止哺乳4 h及以上[5];乙醇过敏者禁用该显像剂。
药物干扰
ER拮抗剂,为避免竞争性结合所致的假阴性,ER拮抗剂需停用至少5周,三苯氧胺(他莫昔芬)和氟维司群要求更为严格,需停药分别达8周和28周以上方可显像。芳香化酶抑制剂、CDK4/6抑制剂和黄体生成素释放激素(luteinizing hormone releasing hormone,LHRH)拮抗剂因不会与ER结合,故无需停药[29]。
禁食
鉴于血糖水平不会干扰显像,一般无需禁食。但为减少肠道生理性排泄引起的干扰,对腹盆腔怀疑有转移的患者可考虑禁食4h[30-32]。
肝肾功能
18F-FES的代谢产物可通过肝、肾两种途径排出体外。但因代谢速度较快,轻度的肝肾功能损害不会影响显像结果[29]。
显像流程
显像剂注射
推荐剂量为 111~222 MBq (通常为185 MBq),以20 mL生理盐水稀释后以1~2 min的速度缓慢注射[5]。
注射后准备
注射显像剂后等候期的要求同常规18F-氟脱氧葡萄糖(fluorodeoxyglucose,FDG)显像,但无需禁言,允许自由行走。建议患者注射显像剂前饮水1 L或注射后饮水0.5 L,以加快泌尿系统排泄,减少辐射[29]。
显像时间
因注射18F-FES后10~20 min其在血液中浓度达到高峰,之后迅速清除,在20~120 min内维持稳定,故需在注射显像剂后120 min内显像,但不得早于20 min。多数研究中,显像时间设定为注射显像剂后的(60±10)min[29]。
图像采集
同常规18F-FDG显像。建议患者的手臂应置于头部上方,以避免伪影。患者无法配合的,手臂可沿身体一侧放置。采集范围建议从颅底到股骨中段[33]。每个床位的扫描时间取决于患者的体重和给药剂量(表2)。
表2 基于患者体重和注射剂量的采集速度(以西门子mCT Biography机型为例,每床位)

辐射剂量和安全性
18F-FES显像时,人体所受的辐射为0.022 mSv/MBq,因此200MBq的注射量时则为 4.4 mSv。受照剂量最高的为肝脏(0.13 mGy/MBq),其次为胆囊(0.10 mGy/MBq)和膀胱(0.05 mGy/MBq)。人体内吸收剂量的高低依次为胆囊壁、膀胱壁、小肠、上部大肠和肝脏,分别为0.07、0.04、0.04、0.03和0.03 mGy/MBq;而放射性敏感的器官,如胸腺、骨原细胞和红骨髓等的吸收剂量则较低,为0.00~0.02 mGy/MBq。全身平均吸收剂量、有效剂量当量和有效剂量分别为0.01、0.03和0.02 mSv/MBq。当注射185 MBq(5 mCi)的18F-FES时,人体有效剂量为3.52 mSv [34]。因此,18F-FES的有效剂量在允许范围内,可安全地用于临床显像。
图像分析
正常生物分布
肝、胆道系统、肠道和膀胱内的生理性分布较为明显,全身其余部位本底较低,故需根据所需观察的部位选择合适的阈值范围(图1)。部分患者可在注射侧静脉内见条索状放射性残留,极少数患者垂体部位亦可见轻中度生理性摄取[5,35]。
ER阳性和阴性的判定
在进行病灶分析时,建议先行视觉判断,当病灶摄取高于周围正常本底时,需行最大标准摄取值(standard uptake value,SUV)等半定量分
析。鉴于所用仪器和采集条件等不同,ER阳性和阴性的界值从1.0 ~ 2.0不等。迄今为止一项最大的研究根据SUVmax,将病灶ER表达分成3类<1.5为ER阴性,1.5 ~ 2.5为可疑阳性,≥2.5为阳性[11](图2)。建议各中心结合自身实际,提出自己的参数用于分析。
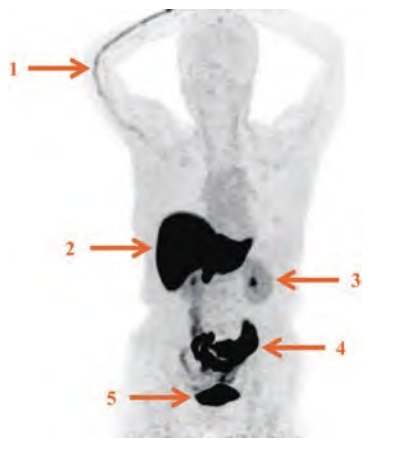
图1 18F-FES生物分布
1:注射侧血管显影;2:肝;3:肾;4:肠道;5:膀胱
病灶部位
18F-FES PET在包括骨骼、淋巴结和脑等多个解剖部位对ER阳性病灶有较高的检测敏感性,其可作为18F-FDG或磁共振成像(magnetic resonance imaging,MRI)等的有效补充,对传统影像学检查无法明确的病灶有提示作用(图3)[5]。肝脏和胆道系统由于较高的本底,在分析图像时或不够准确,但利用背景校正或有助于提升对肝脏病灶ER的判断能力:以靶本比<0.33和≥0.73作为肝脏ER阴性和阳性区分的界值时,阳性预测值和阴性预测值分别高达100%和75%,但该结论尚待进一步大样本、前瞻性研究加以证实[36]。
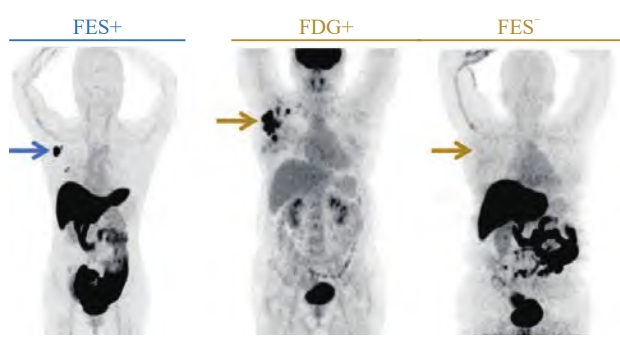
图2 18F-FES阳性和阴性典型病例
蓝箭头:右腋下淋巴结提示18F-FES高摄取,SUVmax = 13.1,病理学检查结果证实为ER+;黄箭头:右腋下淋巴结提示为18F-FDG高代谢,SUVmax = 12.3,但未见18F-FES摄取增高,SUVmax仅1.3,病理学检查结果为ER-)
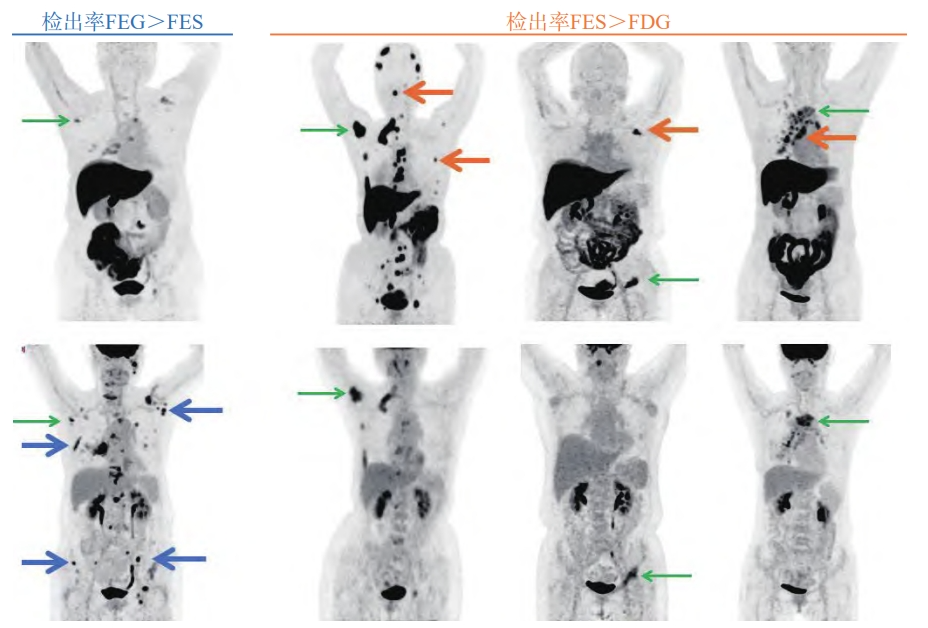
图3 18F-FES和18F-FDG诊断价值比较
上排18F-FES、下排18F-FDG显像;蓝线:18F-FDG上发现更多的18F-FES阴性病灶;黄线:18F-FES可作为有效补充,发现18F-FDG阴性的转移灶。
影响因素
影响因素可分为内部和外部两方面[37]。
内部因素:① 雌激素水平和月经状态,外周血中雌二醇水平>30 pg/mL或影响18F-FES摄取,由于生理性雌激素与ER竞争性结合,可导致肿瘤部位ER表达降低;② 性激素结合球蛋白(sex hormone binding globulin,SHBG)与SUV呈负相关;③ 体重指数(body mass index,BMI)与SUV呈正相关,但可被基于瘦脂体重的SUV校正。
外部因素:① 治疗史,内分泌治疗药物影响见前述,放疗会引起肺部弥漫性摄取增高,其机制尚不明确[38];② 设备分辨率:随着PET设备的更新,目前其分辨率可达2~4 mm,甚至更小,此外,若病灶ER表达强烈,即使很小的病灶也可存在显著的摄取增高[29]。
假阴性和假阳性
假阴性主要见于绝经前的妇女,或由绝经前妇女外周血中的高雌激素水平所致[39]。假阳性结果可见于:① 骨纤维结构发育不良[40];②肋骨不全骨折[41];③ 放射性损伤[38,41]。
报告书写
一份完整的18F-FES PET报告至少应包含以下内容:① 描述正常生物分布,如肝、肾代谢、排泄情况等;② 描述18F-FES摄取增高的病灶(SUVmax>1.5),并记录SUVmax等;③ 对其他影像学检查[计算机体层成像(computed tomography,CT)、MRI和18F-FDG PET等]提示的病灶,进行ER判读;④ 对临床诊断困难的病灶,提供该部位18F-FES摄取情况,若为高摄取,进行半定量分析(即SUVmax等),并给出ER阳性/阴性的判读,以提示临床;⑤ 对进行ER异质性分析的患者,列出所有已知转移病灶ER表达信息;⑥ 若为疗效评估,列出所有病灶治疗前后的18F-FES变化差异;⑦ 列举非特异性摄取情况,如放射性肺炎等[29]。
局限性
⑴ 18F-FES显像仅可检出有功能的ER病灶,对无功能ER阳性病灶和ER阴性病灶无检出能力,故临床需结合其他影像学检查综合判断,不能单纯以18F-FES显像作为筛查转移灶的工具。
⑵ 进行转移来源判断时,需考虑其他ER阳性的原发性肿瘤,如子宫内膜癌、卵巢癌等,因上述部位来源肿瘤的转移灶亦可表达ER。
⑶ 肝脏作为18F-FES主要代谢场所,本底较高。因此,对仅有肝脏病灶的患者,不建议行18F-FES PET评估ER表达。
展望
目前,欧美等国已有商品化的18F-FES显像剂上市,为不具备合成条件的医院开展18F-FES显像提供了可能性。随着《医用同位素中长期发展规划(2021—2035)》的发布,中国将大力推动核医学服务基层。作为无创评估活体内ER表达的手段,随着个体化精准治疗模式的深入发展,18F-FES PET在乳腺癌中的临床应用必将越来越广泛。
本标准和指南的发布可望为基层医疗机构开展乳腺癌18F-FES ER显像提供参考,为该显像技术的规范化应用提供依据,也将为日后开展全国多中心研究奠定坚实的基础。