根据《Journal of Controlled Release》最新发表的一篇研究报道,研究人员开发了一种新的方法,抑制药物对健康组织的分布,一旦药物在体内扩散也能迅速去除;这可以提高难治癌症影像学诊断的准确性,减少对健康组织的毒性,进一步提高治疗的有效性。
放射性药物作为下一代癌症成像和癌症治疗药物一直备受关注。到目前为止,大多数研究都集中在开发将药物输送到癌症病变的技术上,但一直不可能避免将药物分布到健康组织。
研究组由国家癌症中心探索肿瘤研究和临床试验中心功能诊断开发部的Izumi Umeda领导,Izumi Umeda同时也是Kavli宇宙物理和数学研究所(Kavli IPMU)的项目研究员。研究组还包括Hirofumi Fujii,以及来自千叶大学、Kavli IPMU和京都医学院的多位研究人员,研究结合了核医学、药物传递系统(DDS)和复杂的化学成分,开发了一种控制给药后放射性核素体内动力学的方法。
该团队的方法允许放射性药物在癌症病变中充分积累,同时缩短药物与健康组织接触的时间。这意味着药物可以集中于癌症病变,与传统方法相比,提高其治疗效果。
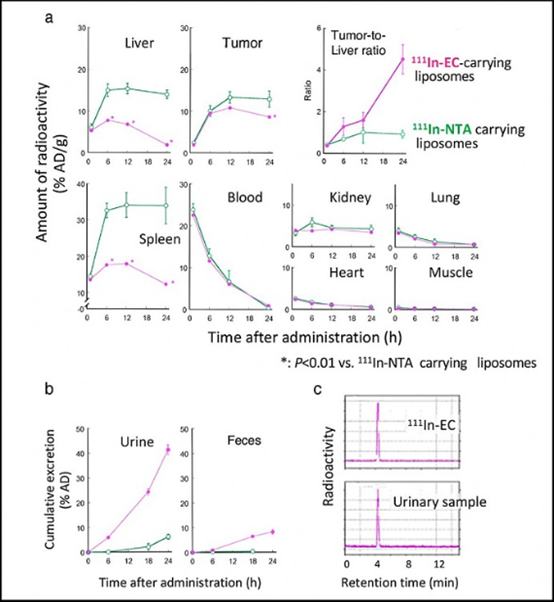
图示为注射111In-EC-脂质体和111In-NTA-脂质体后,111In的放射性在荷瘤小鼠体内的时间依赖性生物分布。图(a)显示每个器官和肿瘤中111In放射性的时间依赖性摄取、保留和清除;图(b)显示111In放射性随时间在尿液和粪便中的累积排泄。图(c)显示尿液中放射性物质的HPLC分析。图片来源:Umeda研究团队
这两种放射性药物或放射性核素(RI)包裹脂质体,具有相同的脂质体组成和颗粒大小,放射性核素同样是111In,只是配体不同。硝基三乙酸(NTA)是一种典型的配体,乙二半胱氨酸(EC)是该团队实验中心的新配体。
两种类型的111In含配体的脂质体被给予肿瘤小鼠,研究人员监测了111In在癌症和健康组织中的摄取和积聚,特别是肝脏和脾脏。两种小鼠的肿瘤差异不大,但在肝脏和脾脏中,111In-EC -脂质体一旦被吸收,可以迅速清除;而传统的111In-NTA -脂质体则会保留很长时间。111In-EC -脂质体也能促进排泄到粪便中,尿液中的化学形式为111In-EC,而不在脂质体中。
研究小组发现:在肝脏中,脂质体被分解,释放出内部的111In配体复合物;而在肿瘤中,脂质体长期保持完整,111In配体复合物仍留在脂质体中。独特的复合物111In-EC,允许从脂质体释放后从肝脏快速清除。
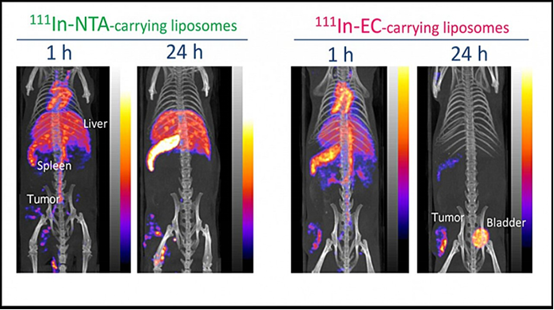
图示为荷瘤小鼠分别给药111In-EC -脂质体和111In-NTA -脂质体,1小时和24小时后的SPECT/CT成像。图片来源:Umeda研究团队
从刚完成给药111In-EC -脂质体或111In-NTA -脂质体后的荷瘤小鼠的体内SPECT/CT图像来看,两种脂质体在体内的分布几乎相同。然而,后来,111In-EC -脂质体明显出现在肿瘤部位,而在肝脏和脾脏的图像信号微弱可忽略不计;而111In-NTA -脂质体由于肝脏和脾脏的清除率较低,已经无法选择性地成像肿瘤。这些图像与上述生物分布研究一致。
基于这项研究的结果,该团队提出了一种方案解释携带放射性核素脂质体在体内代谢的过程。静脉给药后,常规的111In-NTA脂质体和新的111In-EC -脂质体在血液中循环,并在肿瘤中积累到类似的程度。大多数脂质体在肿瘤内长期保持完整,因此,包裹的放射性核素配体复合物被保留在脂质体中。之后,脂质体被肝脏吸收,在那里它们被迅速降解并释放其包裹的111In-配体复合物。
传统的111In -配体复合物,即111In-NTA,从脂质体释放后,在肝脏中停留了很长时间。相比之下,111In-EC能够从肝脏中逸出,并以其原始形式迅速随尿液排出。研究人员表示,这种快速随尿液排出而不在其他组织中积累,将使放射性物质迅速从体内清除,并将损害降至最低。
Umeda及其团队表示:“事实表明,这是一种新的药物开发方法,从一个新的角度来保持药物在癌症病变中的浓度,同时保护健康组织,这一点至关重要,尤其考虑到精准癌症治疗或治疗学在治疗难治性疾病中发挥的作用。在未来,我们希望进一步的研究将使药物只停留在癌症病变中,这是以前从未实现的。”