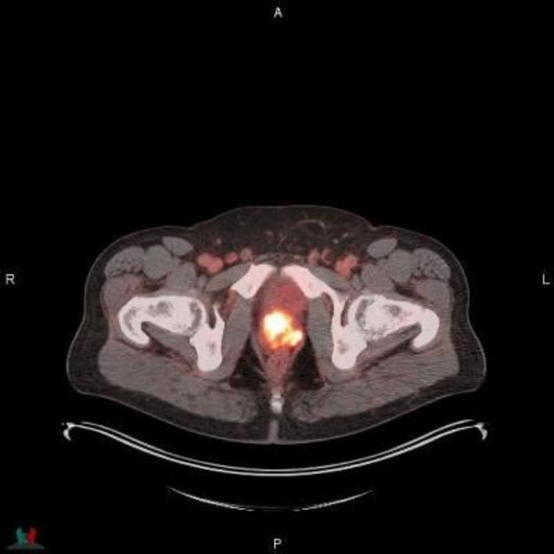
POSLUMA (flotufolastat F-18) PET/CT图像显示前列腺摄取,符合原发性前列腺癌。
图片由Blue Earth Diagnostics提供
Bracco企业集团的Blue Earth Diagnostics是创新正电子发射断层显像(PET)放射性药物开发和商业化的新兴领导者,近日宣布了Ⅲ期LIGHTHOUSE试验(NCT04186819)的亚组分析结果,该试验评估了POSLUMA (flotufolastat F-18) PET在新诊断前列腺癌患者中的安全性和诊断性能。具体而言,该亚组研究了flotufolastat F-18 PET在常规成像结果为阴性的新诊断高危前列腺癌患者中的表现。POSLUMA于近期获得美国FDA批准,用于前列腺癌疑似转移患者的前列腺特异性膜抗原(PSMA)阳性病灶的正电子发射断层扫描(PET),这些患者有可能接受初始最终治疗,或基于血清前列腺特异性抗原(PSA)水平升高而疑似复发。
结果亮点:
• 在174例接受手术的患者中,flotufolastat F-18检测盆腔淋巴结的灵敏度和特异度分别为24-33%和92-96%。
• 197例患者中,flotufolastat F-18对前列腺癌M1期(扩散至盆腔以外的病变)的检出率为14-25%。
• 在已识别的病变中,16-25例被成功验证为真阳性,M1期的验证检出率(VDR)为8.1-13%。
医学成像学、医学和生物医学工程学系Phillip H. Kuo博士说:“前列腺癌的有效初始分期,特别是转移性疾病的检测,对患者的最佳临床管理是至关重要的。鉴于常规成像技术所提供的信息有限,PSMA-PET成像的表现满足了一个重要的未满足需求。LIGHTHOUSE研究的分析表明,在常规影像学检查结果为阴性的高危前列腺癌患者中,flotufolastat F-18在术前提供了关于转移性盆腔淋巴结和M1病变的临床有用信息。这些信息可以帮助指导治疗选择,并可能避免对高危疾病患者进行无效的手术。”
Blue Earth Diagnostics CEO David E. Gauden博士说:“我们很高兴在在ASTRO上展示LIGHTHOUSE研究的这些结果。即使在低PSA水平、高亲和力PSMA结合和低膀胱活动的情况下,POSLUMA仍能基于其诊断性能,为医生提供高质量的诊断信息。在一项术后Ⅲ期分析以及临床前和Ⅰ期研究中,POSLUMA显示了膀胱低活动度,为前列腺癌患者的前列腺和输尿管附近区域提供了增强图像评估。该产品使用放射性同位素氟-18 (18F)标记,以利用18F标记的PSMA PET成像的高图像质量,促进疾病的有效检测,并通过我们美国商业制造商和分销商的生产和分销网络,为患者提供广泛的、容易获得的获得途径。国家认可的前列腺癌临床肿瘤指南现在包括POSLUMA,与目前FDA批准的其他PSMA PET放射性药物的所有类别相同。”
上述研究结果在2023年ASTRO年会的海报问答环节中进行了讨论。该论文标题为“18F-rhPSMA-7.3 PET在新诊断高危前列腺癌和常规成像阴性的男性中的诊断性能”,由亚利桑那州图森市亚利桑那大学医学影像、医学和生物医学工程学系Phillip H. Kuo博士进行陈述。
关于这项研究
LIGHTHOUSE数据的亚组分析评估了一组高/极高危前列腺癌患者,这些患者在常规影像学上无淋巴结或转移性疾病的证据。计划行根治性前列腺切除术(RP) ,配合盆腔淋巴结(PLN)清扫术的患者,接受了flotufolastat F-18 PET检查。局部阅片员在RP前和3名中心阅片员盲读之前解读扫描结果。如果局部阅片结果提示M1病变,则在治疗前尝试对PET阳性M1病变进行验证(活检、手术或确证性随访成像)。该分析评估了flotufolastat F-18在高/非常高危患者中检测PLN转移瘤的敏感性和特异性,这些患者的基线常规成像为阴性。他们之后接受了flotufolastat F-18 PET并在随后接受了手术,以组织病理学作为真理标准(SoT)。此外,在所有接受 flotufolastat F-18 PET检查的患者扩展人群中评估了M1的验证检出率(VDR,即在所有扫描患者中,使用组织病理学或随访成像作为真阳性SoT的M1病变患者的百分比),无论是否进行手术。
在174例常规影像学检查阴性的极/高危前列腺癌患者中,PLN检测的灵敏度和特异度分别为24-33%和92-96%。在扩展人群的197例患者中,有28-51例检出前列腺癌M1期, M1期总检出率为14-26%。在已识别的病变中,16-25例被成功验证为真阳性(主要使用随访成像SoT),M1期的验证检出率(VDR)为8.1-13%。
LIGHTHOUSE研究中未观察到严重不良事件。总体而言,356例接受flotufolastat F-18诊断的患者中,28例 (7.9%) 发生了至少1次可能与flotufolastat F-18相关的治疗后出现的不良事件。LIGHTHOUSE研究中最常见的不良事件为注射部位疼痛,发生率为0.8% (3/356)。
关于radiohybrid前列腺特异性膜抗原(rhPSMA)
radiohybrid前列腺特异性膜抗原(rhPSMA)化合物由radiohybrid (“rh”)前列腺特异性膜抗原靶向受体配体组成,该配体附着在前列腺癌细胞上并被其内化,它们可以用成像同位素进行放射标记,用于PET成像,或者用治疗性同位素进行治疗,这种方法提供了创造真正治疗技术的潜力。radiohybrid技术和rhPSMA起源于德国慕尼黑工业大学。Blue Earth Diagnostics于2018年从Scintomics GmbH获得了rhPSMA诊断成像技术的全球独家权利,于2020年获得了治疗权利,并将治疗应用转授权给其姊妹公司Blue Earth Therapeutics。Blue Earth Diagnostics用于前列腺癌的radiohybrid PET诊断成像产品,于2023年获得FDA批准。用于潜在治疗的rhPSMA化合物目前处于研究阶段,尚未获得监管部门的批准。
关于POSLUMA的适应证和重要安全性信息
指示
POSLUMA (flotufolastat F 18)注射液适用于前列腺癌患者前列腺特异性膜抗原(PSMA)阳性病变的正电子发射断层扫描(PET)
• 疑似转移,适合初始确定性治疗
• 血清前列腺特异性抗原(PSA)水平升高,疑似复发
重要安全信息
• POSLUMA PET可能出现图像解释错误。阴性图像不能排除前列腺癌的存在,阳性图像不能证实前列腺癌的存在。在患者初始确定性治疗前,POSLUMA对转移性盆腔淋巴结的显像性能似乎受到血清PSA水平和风险分组的影响。POSLUMA对有生化复发证据的影像学前列腺癌患者的诊断效能受血清PSA水平的影响。Flotufolastat F 18的摄取对前列腺癌无特异性,可能发生于其他类型的癌症、非恶性过程和正常组织。推荐临床相关性,可能包括组织病理学评估。
• 疑似前列腺癌复发患者的影像误判风险:POSLUMA PET的解读可能因不同的影像解读者而异,特别是在前列腺/前列腺床区域。由于相关的假阳性解读风险,当临床决策取决于flotufolastat F 18仅在前列腺/前列腺床区域摄取或仅在摄取被解读为交界性时,应考虑多学科会诊和组织病理学确认。
• 使用POSLUMA有助于患者的总体长期累积辐射暴露。长期累积辐射暴露与癌症风险增加相关。建议患者在给药前后补水,给药后经常排尿。确保安全操作,尽量减少患者和医护人员的辐射暴露。
• 临床研究中,≥0.4%患者报告的不良反应为腹泻、血压升高和注射部位疼痛。
• 药物相互作用:雄激素剥夺疗法(ADT)和其他靶向雄激素通路的疗法(如雄激素受体拮抗剂)可能导致前列腺癌患者对flotufolastat F 18的摄取发生变化。这些疗法对POSLUMA PET性能的影响尚未确定。