摘要:
对于存在于大多数组织内的肿瘤标志物而言,适用于全身中长期治疗的“灵丹妙药”仍未找到,其主要原因为血管内皮被动阻碍了靶向药物进入组织,进而影响靶向药物与靶标的接合。PRISM的研究团队设计了第一款“双精度”双特异性抗体,其一臂精确结合肺内皮并驱动主动递送,另一臂精确阻断肺组织内的 TGF-β效应子功能。事实证明,靶向细胞膜穴样内陷以进行经内皮泵送对于在一小时内将大部分静脉注射剂量精确地输送到肺部以及在大鼠肺炎模型中将治疗能力提高 >1000 倍至关重要。超低剂量 (μg/kg) 可抑制炎症细胞浸润、水肿、肺组织损伤、疾病生物标志物表达和 TGF-β 信号传导。
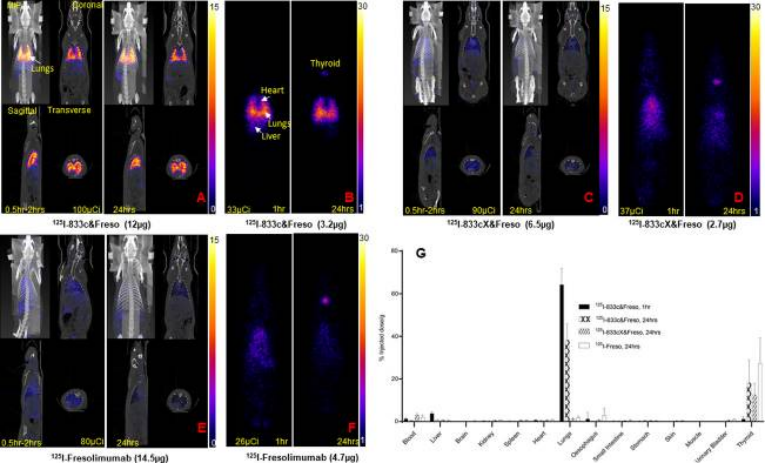
急性肺损伤模型大鼠静脉注射放射性碘化抗体125 I-833c&Freso、125I-833cX&Freso 。
(A、C、E)1 和 24 小时拍摄的大鼠的 SPECT/CT 图像,显示了最大强度投影 (MIP)、冠状、矢状和横截面。(B、D、F)指定时间点的SPECT片层图像。
● 全身 SPECT 成像显示在静脉内注射125I-833c&Freso (iv) 24 或 48 小时后肺部摄取强劲
● 突变体 125I-833cX&Freso 和 125I-fresolimumab 均缺乏 APP 结合,即使在24小时后也没有针对肺部的明显摄取,它们大部分保留在血液中,并显示出预期的非特异性血液分布特征。
结论:在血管内皮中泵送的细胞膜穴样内陷可以将治疗性抗体泵入患病的肺部,从而实现前所未有的精确治疗靶向和疗效